肿瘤在放化疗压力下产生的治疗抵抗是临床肿瘤治疗中的关键挑战,其背后常伴随肿瘤细胞内DNA损伤修复能力异常增强。深入揭示DNA损伤修复关键蛋白的功能与调控机制,对发展新型放化疗增敏策略具有重要科学意义。RNA结合蛋白NONO在DNA损伤修复中扮演关键角色,然而,其功能如何被精准调控,尤其是O-GlcNAc糖基化修饰在其中扮演何种角色,此前尚属未知。
2026年1月14日,河北大学生命科学学院吴琛教授、郭帅副研究员与北京蛋白质组研究中心焦雅洁博士合作,在国际基因组学顶级期刊《Genome Biology》(中科院一区Top期刊,IF5-Year:16.3)在线发表了题为“O-GlcNAcylation of NONO mediates alternative splicing of SETMAR and facilitates NHEJ repair”的研究论文。该研究首次系统阐明了NONO蛋白的O-GlcNAc糖基化修饰通过调控SETMAR基因的可变剪接,进而激活非同源末端连接(NHEJ)修复通路、导致肝癌细胞辐射抵抗的完整分子机制,为逆转肿瘤放疗抵抗提供了全新的表观遗传干预思路。

研究首次发现,电离辐射能特异性增强NONO与O-GlcNAc糖基转移酶(OGT)的相互作用,诱导NONO蛋白第147位丝氨酸(Ser147)发生O-GlcNAc修饰。该修饰如同一个关键的“稳定性开关”,不仅显著提升了NONO蛋白的稳定性,更强化了其向DNA损伤位点的募集能力。进一步的机制解析揭示,被修饰的NONO通过与剪接因子SFPQ协同作用,主导了组蛋白甲基转移酶SETMAR前体mRNA的剪接方向,促使其生成更多长型异构体SETMAR-L。SETMAR-L进而通过在损伤区域沉积H3K36me2这一特定的组蛋白修饰标记,为招募早期NHEJ核心因子Ku70铺平道路,最终大幅提升细胞的DNA断裂修复效率。研究的创新性在于,将O-GlcNAc这一动态修饰、前体mRNA的可变剪接调控与经典的DNA损伤修复通路三者有机串联,揭示了一条全新的细胞辐射抵抗调控轴。功能实验证明,特异性抑制NONO的Ser147位点糖基化,能显著增强肝癌细胞对辐射的敏感性。动物移植瘤模型进一步证实,干预该修饰可有效抑制肿瘤生长并提升放疗效果。这一发现阐明了 O-GlcNAc 修饰在 NONO 介导的 NHEJ 修复通路中的新机制,将对抗放疗抵抗的策略指向了蛋白质翻译后修饰这一可药性较强的层面,具有重要的转化潜力。
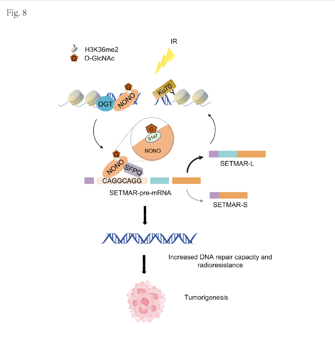
O-GlcNAc糖基化促进NONO介导的SETMAR可变剪切及DNA修复导致辐射抵抗的机制图
河北大学生命科学学院硕士研究生栗梦圆、博士研究生田焕娜、硕士研究生周子怡为本文共同第一作者。吴琛教授、郭帅副研究员与焦雅洁博士为共同通讯作者。该研究获得了国家自然科学基金、河北省自然科学基金及河北省科技计划项目的持续支持。
原文链接:https://doi.org/10.1186/s13059-026-03930-5