2025年2月,《细胞》(Cell)期刊以“Receptor Binding, Structure, and Tissue Tropism of Cattle-Infecting H5N1 Avian Influenza Virus Hemagglutinin”为题,发表了高福院士团队的研究成果。首都医科大学附属北京地坛医院/北京市感染性疾病研究中心研究员宋豪、北京生命科技研究院博士后浩天骄、中国科学院微生物研究所博士后韩普、河北大学硕士研究生王海辰、首都医科大学附属北京同仁医院/北京市眼科研究所张旭医师为本论文共同第一作者;中国科学院微生物研究所高福院士、北京同仁医院/北京市眼科研究所和河南省医科院王宁利院长、北京地坛医院病理科孙磊主任及宋豪研究员为论文共同通讯作者。

自2024年以来,H5N1高致病性禽流感病毒(进化枝2.3.4.4b)在美国的牛群中持续传播并引起人类感染,受到全球广泛关注。2024年4月,得克萨斯州一名奶牛场工人因接触感染 H5N1 病毒的奶牛而确诊,这也是首例报告的牛传人病例,患者主要症状为结膜炎。截至 2025年1月17日,美国已报告67例高致病性H5N1病毒感染病例,其中多数与奶牛接触有关。病毒为何在牛奶中大量存在?为何会导致人结膜炎? 病毒是否已具备人际传播的能力?这些问题亟待解答。
针对首株感染人的牛源H5N1毒株(A/Texas/37/2024),研究人员首先利用免疫组织化学染色等实验发现,该 H5N1 HA 蛋白可强结合牛肺部及乳腺组织,与临床症状相符;相比之下,常见的人季节性流感病毒(H1N1和H3N2)HA 蛋白并不能有效结合牛的相应组织。此外,牛源 H5N1 HA 蛋白还可显著结合人类的结膜、气管、肺及乳腺组织,而H1N1和H3N2病毒的HA蛋白仅能显著结合人气管组织。研究团队进一步利用高分辨率冷冻电镜(cryo-EM)技术解析了该病毒HA蛋白与禽α2-3和人α2-6唾液酸受体的复合物结构,从分子层面上阐明了牛源H5N1病毒在跨宿主传播中的分子机制。以上发现揭示了H5N1病毒与季节性流感病毒存在截然不同的组织嗜性,也提示了对这一新发病原体进行持续监测和深入研究的重要性。
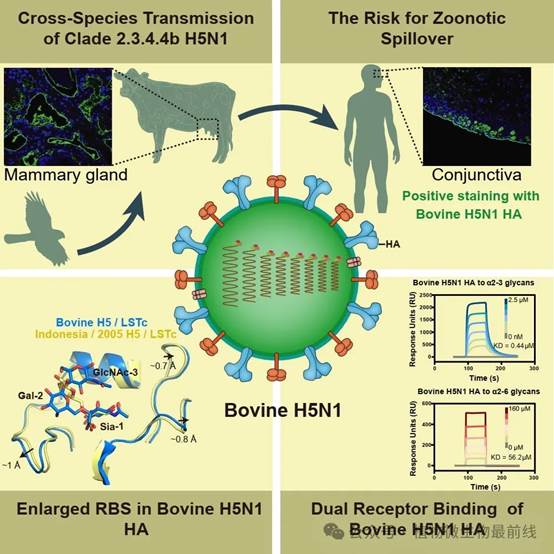
图1. 牛传播H5N1禽流感病毒的跨种间传播机制
原文链接:https://doi.org/10.1016/j.cell.2025.01.019